Vγ9Vδ2 T细胞是一种特化的效应细胞,由于其靶向和改变焦磷酸盐代谢物杀死细胞的能力,作为免疫治疗药物而获得了突出的地位。
2024年2月20日,北京大学魏文胜及中国医学科学院/北京协和医学院黄超兰共同通讯在Cellular & Molecular Immunology(IF=24)在线发表题为“Unsynchronized butyrophilin molecules dictate cancer cell evasion of Vγ9Vδ2 T-cell killing”的研究论文,该研究发现不同步的嗜乳脂蛋白分子指示癌细胞逃避Vγ9Vδ2 T细胞的杀伤。

Vγ9Vδ2 T细胞作为哨兵,对被病原体感染的细胞和磷酸化抗原(pAg)生物合成不平衡的转化细胞进行周围环境调查。这些T细胞可以消灭各种癌细胞。然而,导致癌细胞逃避Vγ9Vδ2 T细胞的细胞毒性作用的遗传因素,包括治疗药物靶向的遗传因素,目前尚不清楚。
BTN2A1和BTN3A1是肿瘤细胞中广泛表达的B7免疫球蛋白超家族成员,是Vγ9Vδ2 T细胞抗癌活性的重要分子促进因子。特别是,BTN2A1已被证明与Vγ9 T细胞受体(TCR)的种系编码区域直接相互作用,而不依赖于pAg暴露。相比之下,BTN3A1与Vγ9Vδ2细胞上的TCR之间的直接相互作用尚未通过转染试验检测到。
然而,针对Vγ9Vδ2 TCR或BTN3A1的定点诱变实验表明,在BTN2A1存在的情况下,这些突变消除了Vγ9Vδ2细胞对TCR的反应性。这一发现表明,靶细胞或T细胞上可能存在一种未知的分子,参与Vγ9Vδ2细胞TCR的识别,并作为协同伙伴。经临床相关药物治疗的癌细胞,如唑来膦酸(ZOL),易被Vγ9Vδ2 T细胞清除。一项临床试验证实了Vγ9Vδ2 扩增T细胞联合ZOL的抗癌作用。此外,ZOL偶联的治疗性抗体被设计用于通过接合Vγ9Vδ2 T细胞靶向癌症。然而,ZOL进入癌细胞及其细胞内转运的确切机制尚未确定。
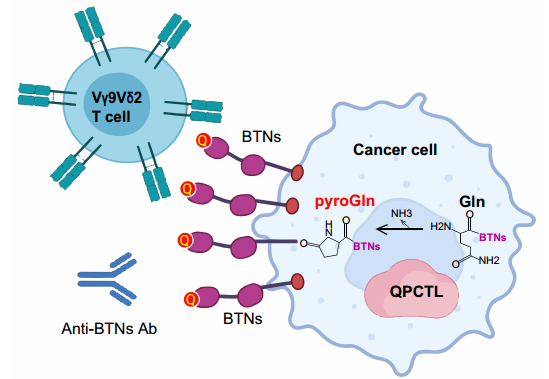
QPCTL对BTN分子焦谷氨酸修饰的示意图(图源自Cellular & Molecular Immunology )
该研究对癌细胞进行了全面的基因组级CRISPR筛选,发现了四个属于嗜乳脂蛋白(Butyrophilin,BTN)家族的分子,特别是BTN2A1、BTN3A1、BTN3A2和BTN3A3,在促进原代Vγ9Vδ2 T细胞对癌细胞的破坏中起着至关重要的作用,并且发挥着独特的、不重叠的作用。这些BTN分子的协调功能是由同步基因表达驱动的,而同步基因表达受IFN-γ信号和RFX复合物的调节。此外,一种名为QPCTL的酶被证明在修饰这些BTN蛋白的N端谷氨酰胺中起关键作用,并被发现是Vγ9Vδ2 T细胞杀死癌细胞的关键因素。该研究提供了癌细胞如何逃避Vγ9Vδ2 T细胞的功能基因组机制的详细概述,还揭示了基因家族成员在调节T细胞活性中的协调表达和功能的重要性。
原文链接:https://www.nature.com/articles/s41423-024-01135-z













